肿瘤免疫疗法沿革
任职于英国剑桥大学的阿根廷科学家César Milstein和德国科学家Georges J.F. Köhler,在1975年将正常的B细胞与骨髓瘤细胞融合,得到可以持续产生特异性抗体的杂交细胞,催生出杂交瘤技术,是人类利用免疫系统的起点。在Milstein和Köhler因此获得诺贝尔奖的同一年,治疗淋巴瘤的理想目标被锁定。1997年,靶向CD20、治疗复发或难治性惰性淋巴瘤的人鼠嵌合单抗Rituximab获批上市,它也成为第一个获批上市的抗癌单抗,开启了全新的癌症治疗方式。此后,随着科学家对癌症基因组学的研究,越来越多的靶点被发现,新的抗癌抗体不断涌现。最激动人心的转折出现在2011年,全球首个免疫检查点抑制剂Ipilimumab获批应用于临床,开启癌症的免疫治疗代。
从杂交瘤技术诞生,到2014年红遍全球的首个全人源PD-1单抗Nivolumab获批,足足间隔了40年。抗癌抗体技术从鼠源、人鼠嵌合、人源化,一步步走向全人源,历经数次激动人心的革新与升级,才成就了今天的安全高效的肿瘤免疫治疗。
鼠源单抗:“一朝被蛇咬十年怕井绳”
抗体的存在直到19世纪90年代才被发现。它识别病毒、细菌、真菌,甚至寄生虫的强大能力,让科学家和医生都“垂涎不已”。经过漫长的上下求索,1960年代科学家才发现只有淋巴细胞可以产生抗体。
抗体示意图一般被画成字母“Y”的形状。可以看到这个抗体由两种颜色组成。其中的蓝色部分,我们叫它恒定区,这个区域比较“保守”,很多不同抗体的这个区域是一模一样的。至于黄色部分,我们叫它可变区。这个区域是千变万化的,可以说没有两种抗体的可变区是相同的,它决定了抗体的特异性。抗体识别病毒、细菌和癌细胞的能力,依赖的就是这个可变区。
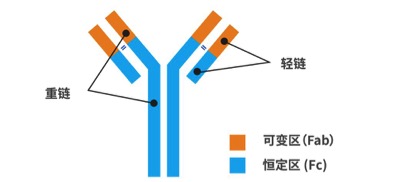
▲抗体示意图
人体的免疫系统有千亿级别的“免疫卫士”——淋巴细胞,它们占到体重的1%左右,但能产生数以百万计的特异性抗体,每一种抗体都能与对应的抗原完美结合,来对抗入侵者。在Köhler和Milstein发明生产单抗技术三年后,37岁的日本分子生物学家利根川进(Susumu Tonegawa)发现了B细胞生产抗体多样性的机制,让从千变万化的抗体中找到“对的人”成为可能。但是新的问题来了:在生产单抗的过程中,制备杂交瘤用的是未经改造的小鼠B细胞和小鼠骨髓瘤细胞。但如果把这种由小鼠产生的鼠源抗体直接用在人身上,人体免疫系统可能会把鼠源抗体当做抗原清除掉,不仅疗效差,还会导致一些安全问题。尽管存在上述风险,但第一个单抗药物Muromonab-CD3(OKT3)还是在1986年被FDA批准上市了。由于OKT3是全鼠源,存在强烈的免疫原性,50%接受治疗的患者产生了抗OKT3的抗体,治疗效果大幅下降。此外,OKT3还会引起类似细胞因子风暴的过敏反应,这在很大的程度上限制了OKT3的临床应用。在OKT3获批之后的近10年时间里,FDA都没有再批准其他的单抗药物上市,单抗药物的研发陷入低谷。
人鼠嵌合和人源化单抗:从“张冠李戴”到“易容术”
科学家们随之想到,只要把鼠源抗体的可变区嫁接到人源抗体的恒定区上,就可以在很大程度上降低抗体的免疫原性。这一设想的最终实现是在1984年,科学家们成功把鼠源抗体用来识别特定抗原的可变区“摘下”,“戴”在了人源抗体的恒定区上,人鼠嵌合抗体应运而生。
不过面对人体的免疫系统,人鼠嵌合抗体依然很容易被清除掉。因此随着人们对抗体可变区认识的加深,在识别特定抗原过程中起到关键作用的可变区碎片被发现,科学家得以给鼠源抗体实施更加精细的“易容手术”。
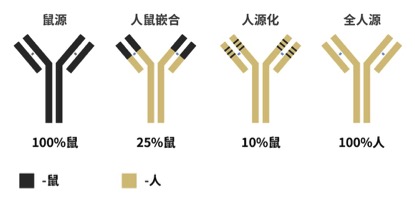
▲各种类型抗体的结构示意图
1986年,Jones等人把鼠源单抗可变区的关键识别区域“抠”下来,然后仅仅把这些可变区碎片替换到人源抗体上,这就成了我们现在常说的人源化抗体。紧随Nivolumab之后获批的Pembrolizumab就是这种人源化抗体。
但是,无论是人鼠嵌合抗体,还是人源化抗体,它们都是科学设想与现实困难之间达成妥协的结果。无论它们携带的小鼠蛋白占比多低,哪怕只占整个抗体的10%以内,都不能完全避免进入人体后的免疫排斥或超敏风险。
唯一的机会就是全人源。
在Milstein和Köhler杂交瘤技术取得成功之际,就有很多科学家尝试将人的B细胞与骨髓瘤细胞融合,以生产全人源的单抗药物。但几乎所有的尝试都是徒劳的,没有人能将二者融合起来。
全人源单抗:噬菌体展示与酵母展示的“帽子流水线”
1970年代,重组DNA技术的建立和发展,打破了不同生命之间的“种属次元壁”。执教于美国密苏里大学的George Smith历经十余年的奋斗,以一己之力于1985年开发出了噬菌体展示技术。五年后,剑桥大学Gregory Winter的团队利用噬菌体展示技术,成功获得了正常折叠且功能完整的人源抗体片段,就是我们前面介绍的黄色可变区。有了这个最重要的部分,只需再通过分子生物学手段把它嫁接到恒定区上,一个完整的全人源抗体就诞生了。
首先,将人体内制造抗体可变区的基因交给噬菌体,噬菌体就会指挥其宿主——大肠杆菌生产出各种抗体可变区,形成一个巨大的“抗体可变区库”。然后再用目标抗原,从这个库里把能与特定抗原结合的抗体可变区“钓”出来即可。不过,噬菌体展示技术的缺点也是显而易见的。它对抗体蛋白的修饰和折叠,与人体细胞差别非常大。一定程度上影响了抗体可变区与抗原的亲和力。
有研究表明,对癌症的治疗而言,治疗效果是随抗体的亲和力增加而增加的。而由噬菌体展示技术获得的抗体可变区,其亲和力通常不足以有效治疗肿瘤。因此,噬菌体展示技术获得的抗体往往还需人工优化。
为了解决噬菌体展示平台面临的问题,K. Dane Wittrup等推出了基于真核生物酵母菌的酵母展示平台。去年年底在国内获批上市的PD-1单抗Sintilimab就是基于这个平台开发的。酵母展示平台实现了从原核表达系统到真核表达系统的进步,不过酵母的蛋白质修饰系统与人体依然有不小的差距,这对抗体功能也存在一定的影响。也正是这种差别在一定程度上限制了酵母展示平台的应用。
据统计,截止2017年5月,全球共有23个全人源单抗药被FDA批准上市,其中通过噬菌体展示技术推出的抗体有6个,酵母展示平台为0,剩余的17个全部来自后起之秀转基因小鼠平台[21]。
真正给全人源抗体领域带来变革的,是转基因小鼠的诞生。
全人源单抗:转基因小鼠带来的真·全人源
就在Smith推出噬菌体展示技术的同一年,如今身为美国科学院院士的Frederick Alt,曾和他的几位同事一起大胆预言:“日渐成熟的转基因技术可以让小鼠表达人的抗体”。
可以说,这一预言为未来数十年的研究指明了方向,越来越多的团队加入转基因小鼠改造的行列。研究的高潮在1997年被点燃,日本麒麟麦酒株式会社的石田功(Isao Ishida)领导的10人研究团队,基本实现了将人的抗体生产系统搬到小鼠体内。石田功正是前面介绍的1987年诺奖得主,利根川进的学生。
在随后的几年里,不同科研团队之间的通力合作,达到人体免疫系统水平的转基因小鼠终于诞生了。
与噬菌体展示和酵母展示平台不同的是,转基因小鼠平台生产抗体的方式,是先破坏小鼠的免疫系统,然后将人体编码抗体的IgG基因转入小鼠体内,并在小鼠体内最大程度再现人体抗体生产系统,产生人源的IgG抗体。从这个层面上讲,它已经优于前述的两个平台了。
另一方面,为了保持抗原可变区的多样性,噬菌体展示和酵母展示依赖于人工引入突变,而转基因小鼠则利用的是B细胞天然自主的体细胞超突变。理论上讲,小鼠作为历经数百万年的进化的生命体产物,其引入突变的方式更优于人工。
酵母展示平台的发明人Wittrup等科学家,对已经获批上市和正在开展2期及以上级别临床研究的所有单抗做了分析。他们发现与噬菌体展示相比,通过转基因小鼠研发出来的抗体药的成药性更好。
至于如何利用转基因小鼠平台生产全人源单抗,以之前介绍过的Nivolumab为例。
首先利用PD-1免疫转基因小鼠,小鼠的B细胞受到人PD-1抗原的刺激之后,会启动体细胞超突变程序,增殖分裂成数以万计、能产生不同人源抗体的B细胞。紧接着,就要用到Köhler和Milstein发明的杂交瘤技术,从被PD-1免疫的小鼠体内分离出B细胞,并与骨髓瘤细胞融合。最后通过层层筛选,找到与PD-1亲和性最高的人源抗体的杂交瘤。
回首通往全人源的“条条大道”,转基因小鼠平台虽较噬菌体展示技术晚出现10年,与酵母展示平台几乎同时登场,但因其在各方面表现出来的种种优势,使其生产的全人源单抗获批上市数量最多。
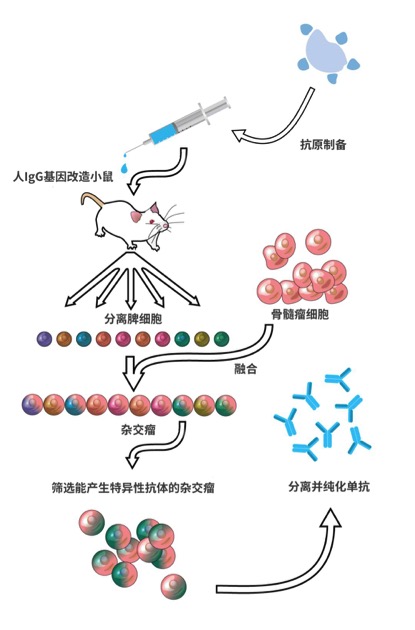
▲转基因小鼠制备全人源抗体示意图
正如著名免疫学家Sefik S. Alkan所说,单克隆抗体的发现改变了生物医学的面貌,并可能在未来几个世纪深入影响我们的生活。

 粤公网安备44010602008088号
粤公网安备44010602008088号